I. Les espèces chimiques
1. Espèce chimique
Définition : On appelle espèce chimique un ensemble constitué d’entités identiques.
Toute espèce chimique possède un nom.
Elle peut être représentée par sa formule chimique.
Elle possède des grandeurs caractéristiques qui permettent de la reconnaître. Citons par exemple son aspect, sa couleur, sa masse volumique, sa densité, sa solubilité dans l’eau (ou dans un solvant), sa température de fusion, sa température d’ébullition etc…
Remarque : Les espèces chimiques qui existent dans la nature sont dites naturelles. Certaines sont fabriquées par l’homme ; elles sont dites synthétiques. On remarquera qu’une espèce chimique synthétique peut être identique à une espèce chimique naturelle.
2. Corps purs et mélanges
Définition :
On appelle corps pur une substance constituée d’une seule espèce chimique.
Définition :
On appelle mélange une substance constituée de plusieurs espèces chimiques.
II Caractéristiques physiques d’une espèce chimique
1. Masse volumique
Définition : On appelle masse volumique d’une espèce chimique le quotient:
?=??
avec
m masse d’un échantillon l’espèce chimique (kg ou g)
V: Volume de l’échantillon (m3 ou L)
?: masse volumique de l’espèce chimique (kg.m-3ou g.L-1)
2. Densité
Définitions :

?=?/????

?=?/????
Remarques :


3. Solubilité
Définition : La solubilité d’une espèce chimique dans un solvant est la masse maximale de cette espèce que l’on peut dissoudre par litre de solution (unité : ??.?−3 ou ?.?−1 ).
III. Extraction et séparation d’espèces chimiques
De nombreux médicaments contiennent des principes actifs d’origine naturelle que le chimiste peut extraire par différents moyens.
1. Extraction par solvant
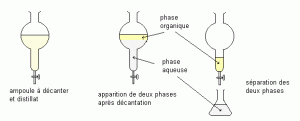
 L’extraction par solvant consiste à dissoudre le composé recherché dans un solvant non miscible avec l’eau et à séparer la phase organique contenant le composé à extraire de la phase aqueuse.
L’extraction par solvant consiste à dissoudre le composé recherché dans un solvant non miscible avec l’eau et à séparer la phase organique contenant le composé à extraire de la phase aqueuse.
Remarque: Le choix du solvant obéit à trois critères et nécessite la connaissance d’un paramètre physique caractéristique de ce solvant.



Remarques:


2. Expression
L’expression permet d’obtenir les produits par pressage.
3. Distillation
La distillation permet de séparer les constituants d’un mélange homogène de liquides dont les températures d’ébullition sont différentes.
4. Filtration
La filtration permet de séparer les constituant d’un mélange solide liquide par passage à travers un milieu filtrant.

Soyez le premier à commenter